





小鼠肝组织解离试剂盒
(Mouse Liver Tissues Dissociation Kit)
产品目录号:TM013
规:12T/盒
目录
1. 说明
1.1 背景信息
1.2 试剂盒组成
1.3 试剂耗材及仪器
2. 试验处理步骤
1. 说明
1.1背景信息
在短时间内高效获得高质量的单细胞悬液,是诸多细胞相关后续实验的先决条件。小鼠肝组织解离试剂盒(Mouse Liver Tissues Dissociation Kit)结合SoniConvert®组织单细胞悬液制备系统可快速获得高纯度、高产量和高活性的单细胞悬液。小鼠肝组织解离试剂中的有效化学试剂成分可对细胞间质进行打孔,从而使解离酶的接触表面积增大,达到快速解离组织的目的。再配合SoniConvert®组织单细胞悬液制备系统中的多向力场作用原理,可快速将细胞从组织上揉取分离,最终实现在无菌条件下快速的组织单细胞化过程。
本品作为特定组织解离试剂盒已被开发应用于从小鼠肝组织中获得单个细胞,能够在短时间内快速获得高质量的单细胞悬液。
1.2试剂盒组成
小鼠肝组织解离试剂盒
(Mouse Liver Tissues Dissociation Kit)
试剂名称 | 规格(mL) | 数量(瓶) |
组织解离缓冲液 Tissues Dissociation buffer,Buffer-1 | 30 | 2 |
小鼠肝组织解离剂 Mouse Liver Tissues Dissociation Solution,ML-Type Solution | 2.5 | 1 |
解离缓冲液 Dissociation solution,Buffer-2 | 2.5 | 1 |
细胞保护液缓冲液 Cyto-protection Solution,Buffer-3 | 12 | 1 |
1.3试剂耗材及仪器
Ø 小鼠肝组织解离试剂盒;
Ø SoniConvert®组织单细胞悬液制备系统;
Ø 37℃恒温摇床;
Ø 低温水平离心机;
Ø 1.5mL EP 管,50mL离心管;
Ø 40-70μm滤网;
Ø D-Hanks
Ø 红细胞裂解液;
2.实验处理步骤
▲ SoniConvert®组织单细胞悬液制备系统详细使用步骤请参考仪器操作使用说明书;
▲用于原代细胞培养实验,以下操作步骤均需在无菌条件下进行;
▲加入小鼠肝组织解离试剂后,放置于37℃恒温摇床孵育时转速控制在60转以下;
2.1 组织解离器具准备,清洁消毒;
2.2 无菌条件下取出肝组织;
2.3 将离体肝组织转移至含预冷的D-Hanks平皿中,采用预冷的D-Hanks清洗组织1-3次(视组织含血量而定),使用无菌眼科剪剔除看得见的血管、结缔组织、纤维成分、凝块等,该操作全程于冰上进行;
2.4 取清洗后的肝组织50-150mg左右(根据所需细胞量决定组织量)转移至1.5mL 灭菌的EP管中,加入800μL组织解离缓冲液(Buffer-1),置于冰上;
2.5 使用无菌眼科剪,将组织剪碎成2mm3左右的小组织块;
2.6 加入200μL小鼠肝组织解离试剂(Mouse Liver Tissues Dissociation Kit)反复颠倒摇晃混匀10s;
2.7 将EP管放到37℃恒温摇床解离软化,其间摇床以60转/分钟震荡,每隔2分钟取出颠倒摇晃混匀10s,孵育时间控制5min内,
2.8 将步骤2.7EP管中上清液取出转移至2.11滤网上过滤,向原EP管加入600μL的Buffer-1;
2.9 针对沉降组织:将解离后的肝组织采用SoniConvert®组织单细胞悬液制备系统进行揉取处理,选择自主处理模式:强度P3挡位,将探头深入至管底与组织接触缓慢上下搅动、组织块,持续3-5s,至70%以上组织块被大部分解离、或彻底消失,如果组织块用量大于100 mg,可重复该步骤1次;
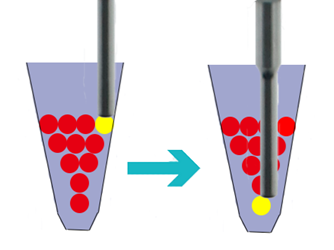
2.10(可选)依据处理组织后的粘稠情况,视情况加入200μL 解离缓冲液(Buffer-2),混匀处理5min;
2.11 将解离后的单细胞悬液采用滤网(依据细胞大小选择40-70μm滤网)过滤至无菌50mL离心管中;
2.12 加入5mL预冷的D-Hanks溶液冲洗滤网至步骤2.11中的50mL离心管中,4℃500g离心5min,去除上清;
2.13(可选)根据实验是否需要去除红细胞,将红细胞裂解液加入细胞沉淀中混匀处理5min;
2.14 4℃ 500g离心5min,弃上清;
2.15加入100-1000μL 细胞保护液缓冲液(Buffer-3)重悬;
2.16 用细胞计数板或全自动细胞计数器对细胞计数,根据需求用Buffer-3或PBS(PH:7.4)调整细胞浓度至1×105至1×107个/mL。
